一、什么是疏水色譜?
? 蛋白等大分子電解質在不含鹽的水溶液中,由于同種電荷會發生靜電相互排斥作用,因此溶解度不高。添加鹽會削弱靜電排斥作用并提高溶解度,即所謂salt in(鹽溶)現象。進一步提高鹽濃度,與蛋白結合(水和)并穩定其溶解的水會被鹽奪走。其結果是,被水和覆蓋的疏水部位露出,引起彼此之間的疏水相互作用并開始沉淀,即所謂salt out(鹽析)現象。在疏水色譜中,使用高濃度鹽的流動相,在導入了疏水性官能團的填料和分析樣品之間產生疏水性相互作用,使得樣品組分結合到填料上。其后,逐漸降低鹽濃度,疏水性相互作用減弱,分析樣品從填料中被洗脫出來。分析樣品不同組分其相互作用的程度不同,因此,可在不同鹽濃度下發生洗脫。氨基酸組成和立體結構是決定疏水性的重要原因,同時疏水相互作用和分子尺寸之間也有較弱的關聯。一般而言,分子量越大,疏水相互作用表現出越強(=洗脫遲緩)的趨勢。
二、色譜柱(填料)的選擇
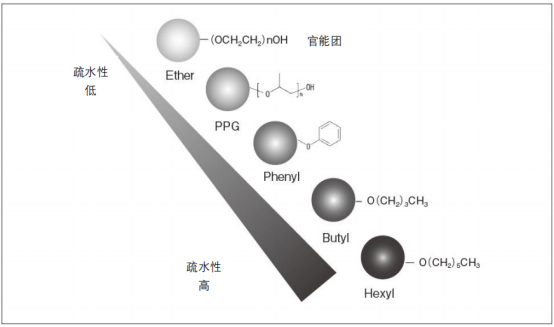
?官能團的種類和疏水性的強弱如下圖所示。雖然疏水性的強弱基本取決于官能團,但還是會受到鍵合密度的影響,密度越高,疏水性越高。另外,芳香族官能團和脂肪族官能團,受π電子引起的相互作用的影響,選擇性上存在略微差異。
? 考慮分析樣品向孔內部的滲透、擴散引起的傳質效應,一般選擇較大孔徑的(例如,約100 nm)填料。但在純化過程中,考慮到效率,有時也會選擇對實際分析樣品吸附載量最大所對應孔徑的填料。TOYOPEARL Phenyl-600、PPG-600、Butyl-600等600系列的孔徑設計為75 nm左右,大多用于分子尺寸與抗體相同或類似的分析樣品的純化。TOYOPEARL Butyl-550的孔徑設計得較小,約為50 nm,適用于小分子蛋白和肽的純化。疏水色譜中使用的基質如下表所示。非多孔性填料是在無孔聚合物基質填料表面導入了疏水官能團的高速、高分辨率用填料。無需考慮向孔內的擴散,因此適用于所有分子尺寸的分析樣品。然而非多孔性填料的有效表面積較小,導致樣品載量較少,同時還需要注意雜質可能造成的污染。
?使用梯度洗脫時,色譜柱長度對分辨率的影響較小,不需要為了提高分辨率而增大色譜柱長度。另一方面,在吸附載量較重要的純化工藝中,色譜柱長度則對動態吸附載量有影響。特別在高流速條件下使用長度較短的色譜柱時,由于動態吸附載量較低,需要考慮處理能力時,最好采用相同的色譜柱長度(或柱床高度)或至少10 cm以上長度的色譜柱進行規模放大研究。
疏水色譜用填料基質的種類和特點
基 ??質 | 優 ??點 | 缺 ??點 |
聚合物類填料 (多孔性填料) | 吸附載量高 有耐堿性 易于放大 | |
聚合物類填料 (非多孔性填料) | 高速、高分辨率 有耐堿性 適用于所有分子尺寸的分析樣品 | 載量低 對雜質造成的污染敏感 |
三、流動相的選擇
?在疏水色譜中,緩沖液的種類對選擇性幾乎沒有影響。大多推薦使用在中性附近具有緩沖能力的20~100 mmol/L左右的磷酸鹽緩沖液或Tris鹽酸鹽緩沖液,加入1~2 mol/L左右的硫酸銨作為流動相使用。硫酸銨價格低廉,水溶解度高,在低溫條件下,溶解度也不會下降。由于選擇性的不同,有時也使用硫酸鈉或氯化鈉。但硫酸鈉在低溫下溶解度會大幅下降,需要注意鹽析現象。
?初始鹽濃度設定為分析樣品不會發生沉淀的鹽濃度。通常情況下,預先配制添加了多種濃度的硫酸銨(1~2 mol/L)樣品,將上清液和沉淀物分別使用SDS-PAGE等,計算分析樣品不發生沉淀的最高硫酸銨濃度,以該濃度作為初始流動相的鹽濃度。盡量使用高鹽濃度的初始流動相,鹽析沉淀的雜質可以事先通過過濾器過濾和離心法去除。
?分析樣品的疏水性較高時,即使降低鹽濃度,也無法洗脫,或峰形展寬。此時,推薦可將少量的水溶性有機溶液(例如,異丙醇等)添加到鹽濃度較低的流動相中。在疏水色譜中,使用鹽濃度較高的流動相,因此,添加有機溶劑時,要注意鹽的析出。另外,添加有機溶劑,色譜柱壓力會升高,因此還需注意壓力上升,根據需要調整流速。
?
四、分離示例
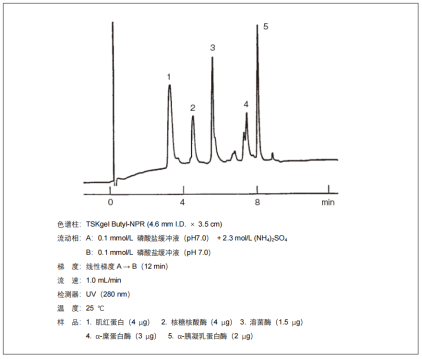
1.?標準蛋白的分離示例
? 標準蛋白分離示例如下圖所示。大多情況下,流動相使用磷酸鹽緩沖液(pH?7.0)。
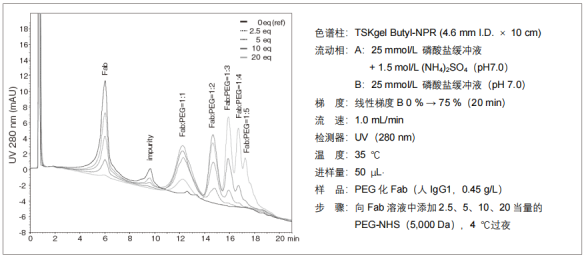
2.?PEG 化蛋白的分離
?導入PEG,疏水性會增大,因此可以觀察到與PEG導入數相對應的色譜峰。下圖顯示了在木瓜蛋白酶水解后的人抗體片段(Fab)中使用PEG-N-羥基琥珀酰亞胺酯(NHS)衍生物制作的PEG化Fab的分析示例。
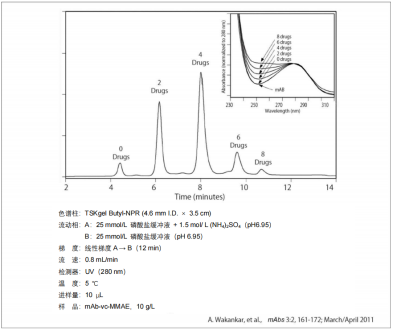
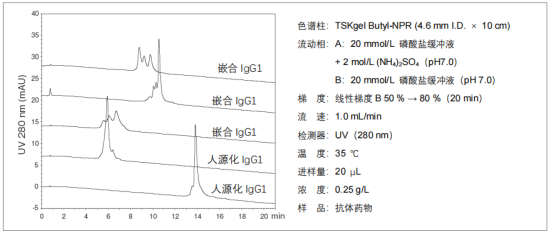
3.?抗體藥物的分離
? 抗體異構體的分離大多使用陽離子交換色譜,但使用疏水色譜,可以得到選擇性與離子交換色譜不同的結果。5種市售抗體藥物的異構體分析示例如下圖所示。每種抗體都分離出了多個色譜峰。
4.?ADC(Antibody-drug conjugate)的分離
? ?ADC是將抗體和小分子藥物偶聯到一起的藥物。抗體對癌細胞等表面存在的抗原進行識別/結合,被吸收到細胞內后,在細胞內部與抗體結合的藥物顯示出藥效,可以選擇性地只殺死特定細胞。通常1個抗體偶聯3~4個小分子藥物。未偶聯藥物的抗體雖然也與抗原結合,但無小分子藥物藥效,只有作為抑制劑發揮作用的可能。相反,過多偶聯小分子藥物時,與抗原的結合能力下降,因此不建議使用。在 ADC質量管理中,關于對藥物引入程度(即DAR:Drug to Antibody Ratio)的評價非常重要。
? 在ADC中,采用了使用抗體攜帶的氨基和還原SS結合生成的巰基導入藥物的方法。由于大多藥物的疏水性較高,因此,測定ADC中的藥物偶聯量時,一般采用疏水色譜。使用TSKgel Butyl-NPR分析ADC的示例如下圖所示。分析結果表明,二硫鍵還原后生成的巰基與藥物很好地偶聯上了。